Hoy en día la tecnología del Litio es la puntera en las baterías desarrolladas para el consumo (teléfonos móviles, ordenadores portátiles, tabletas) y en desarrollo para el coche eléctrico, aunque hay híbridos que utilizan las baterías de NiMH, y algún eléctrico ‘casero’ o ‘convertido’, así como las primeras versiones del EV1, utilizaban las baterías de plomo para ser sustituidas posteriormente por baterías de NiMH. Sin embargo, la siempre baja densidad de energía, hizo falta que se recurriese a las baterías con mejor densidad que se conocen hoy en día, las baterías de Litio.
La tecnología de las baterías de litio no es nada novedosa, ya que fue desarrollada en los 70, si bien es con la aparición de la informática y telefonía móvil donde empezaron a usarse con más profusión. Este tipo de aplicaciones ha favorecido mucho la investigación y desarrollo de este tipo de tecnología, especialmente en la búsqueda de la densidad de energía y precio.
Es por eso que se han alcanzado grandes mejoras en la densidad energética, energía específica, precio, proceso de fabricación, vida útil, costes, tamaño, peso, control y todo lo asociado con estas baterías, pero siempre alineados con el tipo de utilización de las mismas: alimentar equipos electrónicos de bajo consumo, durante muchas horas o días, y con tensiones bajas, menores de 20V, siendo habitual las baterías de una sola celda, con electrónica de control integrada. Es decir, no se ha avanzado mucho en la potencia específica.
Hay muchas variantes de baterías de litio, aunque la mayoría utilizan óxido de cobalto litio, óxido de manganeso (spinel) o óxido de hierro fósforo litio en el polo positivo, no todas valen para vehículos eléctricos. En el polo negativo también hay varias opciones, aunque lo básico suele ser una fina capa de carbón donde se almacenan los átomos de litio de forma intersticial (LiC6). Todas utilizan un electrolito orgánico, con varias formulaciones, algunas de las cuales incluyen el arsénico, flúor, fósforo, boro y otras materias poco habituales.
La razón por la que se utiliza un electrolito orgánico es debido a que el litio es altamente reactivo con el agua, así que se procura mantener siempre todo rastro de humedad lo más lejos posible. Hasta cierto punto esto es de esperar. Si se pretende tener una gran cantidad de energía almacenada, se deben utilizar elementos que sean muy reactivos, no se puede esperar de otros elementos inertes que presenten la misma capacidad.
De hecho, la mayor innovación en este terreno, es el cambio de un electrolito en estado líquido o pastoso, por uno sólido, del tipo polímero, resultando en lo que se conoce como baterías de Litio-polímero, abreviado Li-pol o Li-poly [1].
Por eso el litio es tan interesante [2]. Es un átomo pequeño, con sólo tres electrones, tres protones y un puñado (tres o cuatro, según que isótopo sea) de neutrones. La configuración es tal que tiene un electrón exterior y dos de interiores, pero aún así su tamaño es pequeño, y el último electrón es relativamente fácil de arrancar, aunque al estar cerca del núcleo, el coste energético es elevado. Por eso tiene una tensión de celda tan alta: hace falta un elevado potencial eléctrico para que esto suceda.
También al ser pequeño, es ligero, pues es el tercero de la tabla periódica. No es como el plomo que tiene muchos más electrones y mucha más masa, para utilizar un solo electrón. Por eso es difícil de encontrar un elemento más adecuado que pueda alcanzar semejantes densidades energéticas. Aunque el hidrógeno es interesante, éste es tan especial que se merece una entrada aparte. No en vano hay bastante expectación al respecto del mismo.
Desde el punto de vista eléctrico, el litio ofrece la mayor de las densidades de energía que hay en el mercado. Los valores de energía por Kg se mueven en el rango de 100 a 500Wh/Kg y entre 250 y 1000Wh/l. La potencia específica se encuentra entre 200 y 1500W/Kg, aunque por regla general, mayor potencia específica siempre se corresponde con menor densidad de energía.
Si repasamos la segunda entrada de esta serie, veremos que para corrientes elevadas, hace falta tener cables de cobre relativamente gruesos [3]. Pero como resulta que uno de los terminales es cobre [4], y el otro de aluminio [5], al ser éste último peor conductor eléctrico [6], hace falta mayor volumen del mismo, alrededor del 60% más que del correspondiente de cobre, aunque debido a su menor densidad, el peso es parecido entre ambos terminales.
Los aparatos móviles, que es donde se usan las baterías de mayor densidad de energía utilizan terminales positivos y negativos que son muy finos, como el papel de fumar, igual que el electrolito polimérico, que también es un papel impregnado de electrolito. Pero eso pone limitaciones en la corriente que puede circular en ambas direcciones, reduciendo la potencia tanto en carga como en descarga. No en vano muchos de estos dispositivos cargan en más de hora y media, y la duración puede ir desde esa misma hora y media, hasta varias semanas. Eso permite minimizar la C máxima a 1 o menos, para permitir reducir al absoluto mínimo los grosores de los polos. Con gruesos de una decena o dos de micras (0.02mm), uno se puede apañar sin ningún tipo de problema para manejar 1 o 2 amperios, incluso 6 o 7.
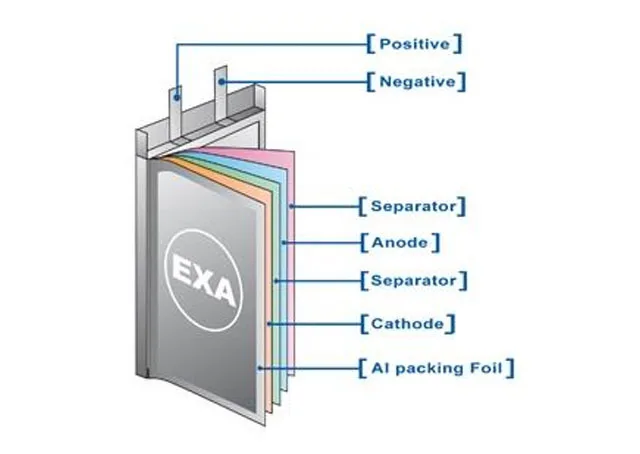
Sin embargo, las baterías de automoción requieren manejar cientos de amperios, dos órdenes de magnitud por encima que una batería comercial. Eso no lo soportan similares papelitos metálicos. Hace falta algo más grueso, del orden de décimas de milímetro o más. Más o menos, el mismo espesor que el electrolito de la batería, que es el que en realidad almacena la energía.
Este mayor espesor de los conductores para poder permitir las elevadas corrientes de más de 300 A requeridas significa que hay menos espacio para el litio, o que la batería, para la misma cantidad de litio, necesita más volumen, y por tanto, menor densidad energética, tanto por volumen como por peso.
Es un límite impuesto por los requerimientos de potencia, y afecta mucho a la densidad de energía. Los electrodos necesarios para manejar semejante potencia ocupan incluso más que la parte que la almacena, y eso es algo importante, independientemente de quién almacene esta energía, por tanto, es un límite muy difícil de franquear, y que aleja bastante las capacidades que se pueden obtener de lo que realmente uno espera cuando mira a otros equipos. No es algo exclusivo de las baterías de Litio.
Un aspecto positivo de tener este tipo de arreglo, es que facilita mucho la refrigeración de las baterías. El cobre es uno de los mejores conductores del calor, seguido muy de cerca en orden, aunque la mitad en valor, por el aluminio [7] (ojo con cierto alótropo del carbono, en el primer puesto del ránking). Si a esto le añadimos que la menor densidad de energía significa que tenemos relativamente menos litio por la misma cantidad de batería, la cosa mejora significativamente en este importante aspecto.
El tema de la temperatura, en el caso de las baterías de litio tiene aún más vertientes que para el caso de las baterías de plomo o de NiMH. Para entenderlo mejor, primero hay que ver algunos puntos relativos a la seguridad, y eso pasa por un pequeño inciso sobre química, reacciones de reducción y oxidación, y un problema asociado nada evidente, pero realmente relevante.
Resulta que en el mundo de la química, la misma reacción de oxidación puede tomar forma de varias maneras. Si se hace controladamente, se puede aprovechar para hacer una batería y obtener la energía de forma eléctrica. Si no se hace controladamente, pero ésta es lenta, se tiene un resultado de corrosión, como pasa con el hierro. Si ésta no es lenta, podemos tener el clásico resultado de la combustión.
Hay que destacar que hay varios efectos condicionantes para que eso pase. Uno de ellos es la concentración de oxígeno. En la atmósfera, el contenido de oxígeno es de alrededor del 21%, y la presión es la atmosférica estándar, lo cual no es algo excesivamente elevado, lo cual conlleva a una oxidación relativamente lenta de la mayoría de metales, como el hierro.
Sin embargo, el mismo hierro, con concentraciones mayores de oxígeno, bien por aumento de presión, bien por aumento de la concentración, o ambas cosas, resulta que arde bastante violentamente, hasta el punto que se utilizan lo que se llaman ‘lanzas de hierro’ como sistema de corte.
En el mundo real, hay tres sistemas diferentes que tienen juntos en el mismo ‘envase’ el elemento oxidante y el elemento a oxidar. El primero se llama cohete, de sobras conocido, que lleva ambos elementos en depósitos claramente separados y bien asegurados. El segundo, son los explosivos, que llevan ambos elementos perfectamente mezclados, y el tercero, son las baterías, que también los llevan relativamente mezclados, y en mayor concentración cuanto mayor es la densidad de energía.
El resultado, es que las baterías de litio son muy temperamentales. Si no se tratan bien, pueden desatar una reacción en cadena que las lleva a la combustión, incluso a la explosión. No es un tema baladí, ni siquiera desconocido: General Motors tuvo problemas con su Volta en las pruebas de crash test, que causó mucho revuelo [8]. Tampoco es desconocido el caso de portátiles ardiendo (Sony tuvo muchas experiencias en este campo), o de packs de baterías para coches y aviones radio control [9].
Este incidente forzó el cambio del diseño de la batería del Volt/Ampera, que estaba refrigerada por aire (con lo cual resulta que una parte importante de la misma estaba ‘vacía’ para permitir la circulación del mismo, reduciendo así, todavía más, la energía específica) a un diseño con refrigeración líquida, con el mismo volumen de batería, pero más pesada al sustituir una parte importante del aire interior por agua. Y aumentando la complejidad.
Con la casi obsesión compulsiva hacia los temas de seguridad que tienen los sectores afines a la automoción, este punto tiene unas consideraciones realmente impactantes, además de las implicaciones eléctricas asociadas.
La primera implicación es química: no se puede usar cualquier tipo de polo positivo, puesto que el de LiCoO, que es justamente el que tiene mayor densidad de energía, resulta que es el más temperamental de todos.
El segundo elemento determinante, es la curva de carga y descarga. Si bien la descarga es algo relativamente fácil de controlar, el problema viene, una vez más, por el lado de la carga. La curva de carga y descarga de las baterías de litio es bastante mala, puesto que varía mucho la tensión en función del estado de carga, y también hasta cierto grado, dependiendo de la corriente de carga/descarga.
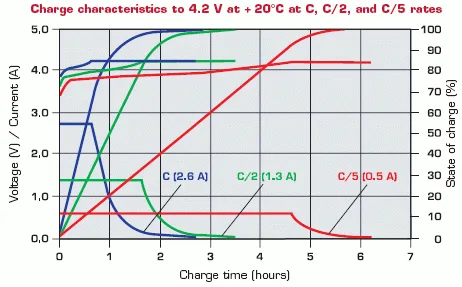
Por ejemplo, una batería totalmente cargada está en los 4,2V, mientras que la descarga se suele cortar alrededor de los 3V, lo cual es una variación de más del 37% sobre la tensión nominal de 3,7V.
El proceso de carga, en realidad, podría superar los 4,2V bajo condiciones ideales, pero por temas de seguridad y de dependencia de la temperatura (una vez más), la carga se puede efectuar entre 1 y 2C hasta que la tensión alcanza los 4,2V, momento en que la carga suele estar entre el 60 y 75% de su capacidad nacional. A partir de ese momento, la corriente se debe limitar para no superar esta tensión, con lo que la velocidad de carga se ralentiza.
Mientras que en la telefonía móvil y la mayoría de aparatos electrónicos trabajan con una única celda de litio, los vehículos eléctricos, al necesitar tensiones elevadas, utilizan muchas de estas celdas conectadas en serie. Eso eleva la tensión tantas veces la tensión nominal como tensión tiene una celda. Es decir, que con 100 celdas en serie tenemos una tensión nominal de 370V, que en realidad se va a mover entre 300 y 420V. La corriente nominal será la misma que para una celda.
Esto que parece sencillo, en realidad tiene un problema más grave subyacente: las celdas es imposible que sean todas exactas. No es raro que haya hasta un 5% de diferencia entre una y otra por lo que hace a capacidad, siendo siempre limitante la que tiene menos. Esto, aparte de introducir pérdidas, también tiene un efecto secundario importante: hay que medir individualmente la tensión en cada celda, así como la temperatura en cada pocas, por no decir individualmente. Esta medida no es sólo informativa, si no que cuando una llega a la tensión nominal de 4,2V, que siempre hay una que llega antes, hay que derivar el exceso de corriente por algún lado para limitar la carga en esa celda. Es lo que se conoce como balanceo de celdas o de baterías [10].
Esta derivación implica que una parte de la energía que entra en el pack de baterías es disipada en resistencias en lugar de ser almacenada. No sólo son pérdidas, sino que también es calor innecesario.
Una vez que una parte importante de celdas ya han llegado a la tensión estipulada, entonces se reduce la cantidad de corriente para todo el pack. Y eso depende de la C que se le aplique de carga, y del estado de las baterías. Para cargas rápidas con hasta 2C, el límite puede llegar a 60% del estado de carga, para bajar a menos de 1C una vez se ha sobrepasado el 70 – 75%. Sin embargo, para cargas lentas, quizás de 0,1C, el límite se alcanza igual al 90%, y con menos pérdidas.
Además, corrientes bajas de carga implican pérdidas bajas debido a resistencias óhmicas, y por tanto, mejoras en el rendimiento de la batería. Es decir, que si una batería de litio tiene un rendimiento (energía utilizada para cargarla/energía entregada en la descarga) generalmente del orden del 95% para cargas y descargas lentas o mejor, bajo condiciones de carga rápida, este rendimiento puede caer por debajo del 90%.
Entonces, para cargas rápidas, que suelen implicar corrientes muy elevadas (y potencias realmente exageradas), las pérdidas internas del pack de baterías generan invariablemente (mucho) calor. Dado que la carga de las baterías de litio está limitada al rango de 0 a 45ºC, no queda más remedio que enfriarlas. Y para enfriarlas hace falta prever algún método de refrigeración, bien aire, bien agua. Lo cual significa espacio ocupado, bajando además la densidad de energía del pack al completo.
Las pérdidas del sistema electrónico de balanceo son básicamente debido al proceso de balanceo en el momento en que empiezan a entrar celdas en la tensión límite, aunque el consumo intrínseco, propio de dicho sistema sea bajo y se cuente en la región de pocos Watios en carga, miliWatios en espera.
Sin embargo, cargas rápidas van a obligar invariablemente a forzar la refrigeración del pack de baterías. Es decir, hace falta algún sistema que refrigeración que habitualmente son compresores o inverters de los que se utilizan para el aire acondicionado, y que suelen consumir entre 1 y 4KW. Potencia que hay que añadir al sistema de carga y que no va a parar a la batería, con lo que aumentan aún más las pérdidas, a la vez que se encarece todo el sistema al tener que ir añadiendo elementos.
Otro aspecto conocido sobre los ciclos de carga y descarga, es que éstos son un límite en las baterías. Habitualmente se suele mencionar que hay un número limitado de ciclos de carga/descarga, que ronda entre los 500 y los 1000 para la mayoría de baterías, aunque para las de automoción esto suele ser bajo, y no es raro que se superen las 5000. La razón: una vez más los gruesos electrodos. No todo iba a ser inconvenientes.

Resulta que uno de los limitantes de la vida de las baterías en lo que a número de ciclos atañe, es debido a que los electrodos cambian de volumen debido a que cambian de composición química: ganan y pierden litio por el propio proceso electroquímico. Esto implica que la superficie del electrodo tiene un estrés mecánico (agravado por la temperatura) debido a estos cambios que acaban por estropear el electrodo. Electrodos gruesos aguantan mejor estos ciclos debido a que aguantan mejor el estrés mecánico, además de ayudar a disipar el calor generado. Sin embargo, cargas rápidas, con sus elevadas temperaturas, son responsables de reducir mucho la vida útil de las baterías.
Por lo que hace a la descarga, resulta que el rango de funcionamiento de las baterías de litio también es mejor que para las baterías de plomo, que trabajan mejor a temperaturas altas, mejor que las de NiMH, que trabajan en un rango bastante estrecho, y su punto más habitual de trabajo son las temperaturas templadas y frías de las zonas centrales y más meridionales de Europa, que precisamente es donde se cuece este bacalao.
De todas maneras, aunque se llevan bien las temperaturas bajas, en algunos casos se ha informado de problemas de falta de potencia a temperaturas bajo cero, al menos al principio, hasta que las baterías se han calentado debido a su uso.
Para aumentar su seguridad, además de tener todas estas medidas de control térmico y de carga, también es obligatorio que vayan selladas dentro de su caja, generalmente de aluminio, soldada y sin capacidad de ningún tipo de intervención dentro de la misma. Además, cuentan con un sistema interno que aparte de medir las tensiones, y también la corriente que entra y sale, hay un sistema de seguridad que corta las dos bornas positiva y negativa del exterior, si por alguna razón el sistema detecta que no es seguro.
Este sistema, llamado interlock, consta de varias partes, y es precisamente el encargado de que las baterías se desconecten en el momento en que éstas son cambiadas, para evitar que el técnico que realiza el cambio se electrocute.
Además, también hay un complejo sistema de detección de fallos que evita que en caso de accidente, si se corta alguno de los cables importantes, el sistema esté alimentado y pueda causar problemas. Si el coche no está ‘arrancado’, tampoco hay tensión en la mayoría de la circuitería de potencia.
Esto obliga a tener un sistema secundario de seguridad, alimentado a otra tensión, con otra batería auxiliar, habitualmente la de plomo de los 12V de siempre. Todo esto, implica una cantidad nada desdeñable de electrónica dentro del vehículo, y que también tiene su consumo eléctrico. Lo suficiente como para dedicarle una entrada en sí misma.
Pero por si los asuntos de seguridad derivados de la temperatura no son suficientes, hay varios aspectos más a resaltar. El primero es la capacidad de la batería. Ésta se reduce con temperaturas muy elevadas, con lo que si el coche está aparcado en un sitio muy soleado y caluroso, pongamos por ejemplo Sevilla en Agosto, al sol, al mediodía, cuando las temperaturas a la sombra pueden superar fácilmente los 45º C, y encima el coche es negro con las lunetas tintadas, resulta que de parado, el sistema puede decidir poner en marcha el aire acondicionado de la batería para evitar que ésta alcance valores excesivamente elevados simplemente por la situación ambiental. O sea, que con el coche parado, hay consumo eléctrico sólo debido al sistema de seguridad y a los problemas con las temperaturas.
Y para rematar, el problema más grueso que siempre se omite cuando se habla de coche eléctrico: la vida útil de las baterías.
El tema viene a colación de que la vida útil está directamente relacionada con la temperatura media a la cual dicho vehículo tiene las baterías, y encima relacionado con el estado de carga. Temperaturas y estados de carga elevados significa que la batería puede durar mucho menos.
Es el extraño caso del depósito menguante. Uno se compra un coche con una autonomía razonablemente corta, y dicha autonomía se reduce un % elevado cada año, con lo que cada año puede hacer menos Km por carga. Y encima, el % depende de la temperatura media, con lo que en países calurosos y soleados, precisamente esos donde es más atractiva la energía solar, son los que presentan más problemas. Hasta que la batería, por debajo de cierto estado de salud, la degradación se dispara y en poco tiempo pasa de tener una capacidad, de, pongamos el 70 – 80% de la nominal a tener una capacidad del 20 – 30%, con la consecuente necesidad de recambio, junto con la posibilidad de otro tipo de fallos algo más, ehm, ‘espectacular’.
Dado el parque de Nissan Leaf que ya se ha vendido, y a que se tiene un buen control sobre el funcionamiento de los mismos, hay ya datos sobre este tipo de comportamiento en la vida útil de las baterías.
Los ingenieros de Nissan han previsto que las rayas del indicador de carga que tiene el cuadro de instrumentos, al estilo de indicador de nivel del depósito, se correspondan con la cantidad de KWh que hay dentro del pack de baterías. Por tanto, a medida que la batería va perdiendo capacidad con la edad, la cantidad de rayitas que se encienden en el cuadro va bajando, y por tanto es relativamente fácil de saber en qué estado está la batería una vez llena.
A partir de esta información y de las reclamaciones que ya ha habido al respecto a Nissan, se ha podido recolectar suficiente información para comparar la realidad de la vida de las baterías en el mundo verdadero, con las teorías que se ponen sobre el papel, y que necesitan ser corroboradas.

En [12] hay un estudio bastante exhaustivo sobre el efecto de la temperatura en el envejecimiento de las baterías de los Nissan Leaf. Sugieren que ésta sigue la ley de Arrhenius, y en concreto han calculado una vida media de la batería, suponiendo el final a la optimista cifra del 70%, para Sevilla, de 4,7 años. Para Dubai, la estimación baja de los 2 años. Mientras, para París y Londres, respectivamente, 8,2 y 8,4 años.
Hay otros efectos que influyen en el envejecimiento sin ser la temperatura, siendo los más destacables los ciclos de carga y descarga, especialmente las rápidas. Esto ha sido también incluido en el estudio, aunque pueden llevar a otro tipo de envejecimiento prematuro, y a largo plazo, va a ser difícil que las baterías duren más de 10 años en ninguna parte del mundo debido a estos otros factores. Presumiblemente nunca pasen de los 6 o 7 años de vida, visto la duración de las baterías [13].
[1] http://en.wikipedia.org/wiki/Lithium_polymer_battery
[2] http://en.wikipedia.org/wiki/Lithium
[3] http://www.powerstream.com/Wire_Size.htm
[4] http://en.wikipedia.org/wiki/Copper
[5] http://en.wikipedia.org/wiki/Aluminium
[6] http://en.wikipedia.org/wiki/Electrical_resistivity_and_conductivity
[7] http://www.engineeringtoolbox.com/thermal-conductivity-d_429.html
[9] http://en.wikipedia.org/wiki/Plug-in_electric_vehicle_fire_incidents
[10] http://en.wikipedia.org/wiki/Battery_balancing
[11] http://en.wikipedia.org/wiki/Interlock
[12] http://www.mynissanleaf.com/wiki/index.php?title=Battery_Capacity_Loss